Gdyby uzyskała aprobatę organów regulacyjnych, stałaby się jedyną dostępną szczepionką na boreliozę (Lyme disease) dla mieszkańców Stanów Zjednoczonych, przeznaczoną dla osób już powyżej 5. roku życia. Jednak oczekuje się, że potencjalna szczepionka pojawi się na rynku dopiero za kilka lat. Jeśli trzecia faza badań zakończy się sukcesem, firmy prawdopodobnie będą się ubiegać o oficjalne zezwolenie na produkcję w 2025 roku.
Nowa szczepionka VLA15 stworzona przez firmy Pfizef i Valner (francuskiego producenta leków) w tym tygodniu weszła w trzecią fazę badań klinicznych przeprowadzanych na ludziach.
„Jesteśmy niezmiernie zadowoleni z osiągnięcia tego ważnego kamienia milowego w rozwoju VLA15” – powiedział w oświadczeniu dyrektor medyczny Valnev, Juan Carlos Jaramillo. „Borelioza nadal się rozprzestrzenia, stanowiąc niezaspokojoną potrzebę medyczną, która wpływa na życie wielu osób na półkuli północnej”.
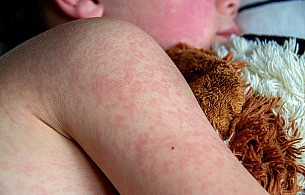
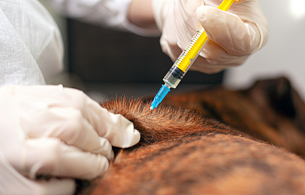
Amerykanie mieli kiedyś dostęp do szczepionki przeciw boreliozie, zwanej LYMERix, ale została ona wycofana z rynku 20 lat temu. Szczepionka miała dość wysoką skuteczność, ale niektórzy użytkownicy obwiniali ją o działania niepożądane, w tym zapalenie stawów. Jak zauważa National Institute of Allergy and Infectious Diseases, „analiza FDA i innych agencji nie potwierdziła tego wniosku” – ale użycie szczepionki gwałtownie spadło, prowadząc do zaprzestania jej produkcji. Na rynku amerykańskim jest dostępna szczepionka dla psów.
Prowadzone obecnie badanie obejmuje około 6,000 uczestników w USA i Europie, którzy mają co najmniej 5 lat i mieszkają w miejscach, w których borelioza jest „wysoce endemiczna” – twierdzą przedstawiciele firm Pfizer i Valnev.
jm